Efficacia terapeutica nelle diverse tipologie di pazienti
L’efficacia di Sofosbuvir/velpatasvir/voxilaprevir (SOF/VEL/VOX) è stata valutata in quattro studi di fase 3, due studi condotti su pazienti precedentemente trattati con DAA e due studi su pazienti naïve ai DAA, con infezione da HCV di genotipo da 1 a 6 senza cirrosi o con cirrosi compensata.
Tabella 2: studi registrativi Sofosbuvir/velpatasvir/voxilaprevir 1
| Studio | Popolazione | Bracci e durata dello studio (Numero di pazienti trattati) | Ulteriori dettagli sullo studio |
| POLARIS-1 (randomizzato in doppio cieco) | Pazienti precedentemente trattati con inibitori dell’NS5A, GT1-6, con o senza cirrosi | SOF/VEL/VOX per 12 settimane (N=263) Placebo per 12 settimane (N=152) | Studio controllato con placebo nel quale i pazienti con infezione di GT1 sono stati randomizzati in rapporto 1:1 a ricevere SOF/VEL/VOX o un placebo per 12 settimane. I pazienti con infezione di GT2-6 sono stati arruolati solo nel gruppo che avrebbe ricevuto SOF/VEL/VOX per 12 settimane. |
| POLARIS-4 (in aperto) | Pazienti precedentemente trattati con DAA (che non avevano ricevuto un inibitore dell’NS5A), GT1-6, con o senza cirrosi | SOF/VEL/VOX per 12 settimane (N=182) SOF/VEL per 12 settimane (N=151) | I pazienti con infezione di GT1-3 sono stati randomizzati in rapporto 1:1 a ricevere SOF/VEL/VOX o SOF/VEL per 12 settimane. I pazienti con infezione di GT4-6 sono stati arruolati solo nel gruppo che avrebbe ricevuto SOF/VEL/VOX per 12 settimane. |
| POLARIS-2 (in aperto) | Pazienti naïve ai DAA, GT 1, 2, 4, 5 o 6, con o senza cirrosi GT 3 senza cirrosi | SOF/VEL/VOX per 8 settimane (N=501) SOF/VEL per 12 settimane N=440) | I pazienti con GT1-4 sono stati randomizzati in rapporto 1:1 a ricevere SOF/VEL/VOX per 8 settimane o SOF/VEL per 12 settimane. I pazienti con infezione di GT5-6 sono stati arruolati solo nel gruppo che avrebbe ricevuto SOF/VEL/VOX per 8 settimane. |
| POLARIS-3 (in aperto) | Pazienti naïve ai DAA con GT 3 e cirrosi | SOF/VEL/VOX per 8 settimane (N=110) SOF/VEL per 12 settimane (N=109) | I pazienti sono stati randomizzati in rapporto 1:1 a ricevere SOF/VEL/VOX per 8 settimane o SOF/VEL per 12 settimane. |
DAA: antivirale ad azione diretta; GT: genotipo; SOF: sofosbuvir; VEL: velpatasvir; VOX: voxilaprevir
GT = genotipo
TN = naïve al trattamento
TE = con esperienza di trattamento (fallimento di trattamento precedente con interferone [IFN] o peginterferone alfa [peg-IFN] con o senza ribavirina (RBV) o intolleranza a terapia pregressa)
L’endpoint primario in tutti gli studi consisteva nella risposta virologica sostenuta (sustained virologic response, SVR), intesa come valori di HCV RNA al di sotto del limite inferiore di quantificazione (LLOQ: HCV RNA di 15 UI/mL) a 12 settimane dopo la fine del trattamento (SVR 12).
Studi clinici in pazienti precedentemente trattati con DAA Adulti precedentemente trattati con inibitori dell’NS5A (POLARIS-1)
La Tabella 3 presenta la SVR12 per genotipo dell’HCV per lo studio POLARIS-1.
Il tempo mediano tra il precedente insuccesso degli DAA e la prima dose di Sofosbuvir/velpatasvir/voxilaprevir per i pazienti arruolati in POLARIS-1 era di 39 settimane (intervallo: da 11 a 299 settimane). Nessun paziente nel gruppo placebo ha raggiunto SVR4.
Tabella 3: SVR12 nei pazienti precedentemente trattati con inibitori dell’NS5A per genotipo HCV nello studio POLARIS-1
| SOF/VEL/VOX per 12 settimane (n = 263) | |||||||||
| Totale (tutti i GT)a(n = 263) | GT-1 | GT-2 (n = 5) | GT-3 (n = 78) | GT-4 (n = 22) | GT-5 (n = 1) | GT-6 | |||
| GT-1a (n = 101) | GT-1b (n = 45) | Totaleb (n = 150) | |||||||
| SVR12 | 96% (253/263) | 96% (97/101) | 100% (45/45) | 97% (146/150) | 100% (5/5) | 95% (74/78) | 91% (20/22) | 100% (1/1) | 100% (6/6) |
| Risultati nei pazienti senza SVR | |||||||||
| Fallimento virologico durante il trattamentoc | <1% (1/263) | 1% (1/101) | 0/45 | 1% (1/150) | 0/5 | 0/78 | 0/1 | 0/6 | |
Recidivad | 2% (6/261) | 1% (1/100) | 0/45 | 1% (1/149) | 0/5 | 5% (4/78) | 5% (1/21) | 0/1 | 0/6 |
| Altroe | 1% (3/263) | 2% (2/101) | 0/45 | 1% (2/150) | 0/5 | 0/78 | 5% (1/22) | 0/1 | 0/6 |
a. Un paziente con genotipo indeterminato ha raggiunto la SVR12.
b. Quattro pazienti presentavano sottotipi del genotipo 1 diversi da 1a o 1b; tutti i 4 pazienti hanno raggiunto la SVR12.
c. I dati farmacocinetici per l’unico paziente con fallimento virologico durante il trattamento erano compatibili con la non aderenza del paziente.
d. Il denominatore per la recidiva è rappresentato dal numero di pazienti con HCV RNA < LLOQ all’ultima valutazione durante il trattamento.
e. “Altro” comprende i pazienti con dati mancanti e quelli che hanno interrotto il trattamento prima della soppressione virologica.
Figura 1: TASSI DI svr12 (%) NELLO STUDIO POLARIS-1
SOF/VEL/VOX 12 SETTIMANE (n:263)

Adulti precedentemente trattati con DAA che non avevano ricevuto un inibitore dell’NS5A (POLARIS-4)5
La Tabella 4 presenta la SVR12 per genotipo dell’HCV e i risultati virologici per lo studio
POLARIS-4. Il tempo mediano tra il precedente insuccesso degli DAA e la prima dose di Sofosbuvir/velpatasvir/voxilaprevir o di sofosbuvir/velpatasvir per i pazienti arruolati in POLARIS-4 era di 76 settimane (intervallo: da 10 a 549 settimane).
Tabella 4: SVR12 per genotipo dell’HCV e i risultati virologici nello studio POLARIS-4
| SOF/VEL/VOX per12 settimane (n = 182) | SOF/VEL per 12 settimane (n = 151) | |
| SVR12 complessiva | 98% (178/182) | 90% (136/151) |
| Genotipo 1 | 97% (76/78) | 91% (60/66) |
| Genotipo 1a | 98% (53/54) | 89% (39/44) |
| Genotipo 1b | 96% (23/24) | 95% (21/22) |
| Genotipo 2 | 100% (31/31) | 97% (32/33) |
| Genotipo 3 | 96% (52/54) | 85% (44/52) |
| Genotipo 4 | 100% (19/19) | 0/0 |
| Risultati nei pazienti senza SVR | ||
| Fallimento virologico durante il trattamentoa | 0/182 | 1% (1/151) |
| Recidivab | 1% (1/182) | 9% (14/150) |
| Altroc | 2% (3/182) | 0/151 |
a. La maggior parte (85%) dei pazienti era stata precedentemente trattata, senza successo, con un regime a base di sofosbuvir.
b. Il denominatore per la recidiva è rappresentato dal numero di pazienti con HCV RNA < LLOQ all’ultima valutazione durante il trattamento.
c. “Altro” comprende i pazienti con dati mancanti e quelli che hanno interrotto il trattamento prima della soppressione virologica.

Studi clinici in pazienti naïve ai DAA Adulti naïve ai DAA con infezione da HCV di genotipo 1, 2, 3, 4, 5 o 6 (POLARIS-2)3
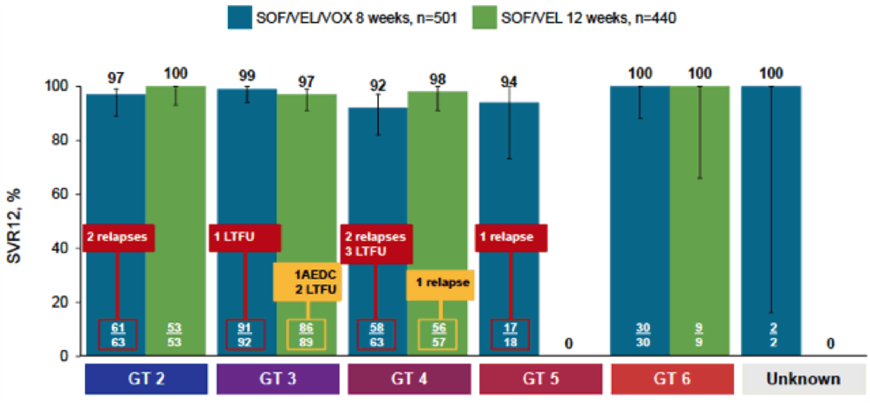
La Tabella 5 presenta la SVR12 per genotipo dell’HCV e i risultati virologici per lo studio POLARIS-2.
Tabella 5: SVR12 per genotipo dell’HCV e i risultati virologici nello studio POLARIS-2*
| SOF/VEL/VOX 8 settimane (n = 501) | SOF/VEL 12 settimane (n = 440) | |
| SVR12 complessivaa | 95% (477/501) | 98% (432/440) |
| Genotipo 1b | 93% (217/233) | 98% (228/232) |
| Genotipo 1a | 92% (155/169) | 99% (170/172) |
| Genotipo 1b | 97% (61/63) | 97% (57/59) |
| Genotipo 2 | 97% (61/63) | 100% (53/53) |
| Genotipo 3 | 99% (91/92) | 97% (86/89) |
| Genotipo 4 | 94% (59/63) | 98% (56/57) |
| Genotipo 5 | 94% (17/18) | 0/0 |
| Genotipo 6 | 100% (30/30) | 100% (9/9) |
| Risultati nei pazienti senza SVR | ||
| Fallimento virologico durante il trattamento | 0/501 | 0/440 |
| Recidivac | 4% (21/498) | 1% (3/439) |
| Altrod | 1% (3/501) | 1% (5/440) |
* Il 23% dei pazienti arruolati in POLARIS-2 era stato trattato in precedenza con un regime a base di interferone.
a. Due pazienti con genotipo indeterminato nel gruppo SOF/VEL/VOX hanno raggiunto la SVR12.
b. Due pazienti presentavano sottotipi del genotipo 1 diversi da 1a e 1b; entrambi hanno raggiunto la SVR12.
c. Il denominatore per la recidiva è rappresentato dal numero di pazienti con HCV RNA
Il trattamento con Sofosbuvir/velpatasvir/voxilaprevir per 8 settimane nello studio POLARIS-2 non ha mostrato una non inferiorità rispetto al trattamento con sofosbuvir/velpatasvir per 12 settimane con un margine predefinito del -5%.
La differenza nella SVR12 è stata dovuta al tasso di risposta inferiore nei pazienti con infezione da HCV di genotipo 1a e/o cirrosi.
Nei pazienti con genotipo 1a senza cirrosi trattati con Sofosbuvir/velpatasvir/voxilaprevir per 8 settimane, l’esito è stato influenzato dai seguenti fattori basali: IMC ≥30 kg/m2, RAV Q80K/L/R, IL28B non-CC, HCV RNA ≥ 800.000 UI/ml. L’SVR12 era del 98% tra i pazienti con due o meno fattori e dell’81% tra i pazienti con tre o quattro fattori. La Tabella 6 presenta la SVR12 per genotipo dell’HCV e stato della cirrosi per lo studio POLARIS-2.
Tabella 6: SVR12 per genotipo dell’HCV e risultati virologici nei pazienti che hanno ricevuto Sofosbuvir/velpatasvir/voxilaprevir per 8 settimane senza cirrosi o con cirrosi nello studio POLARIS-2
| SOF/VEL/VOX per 8 settimane | ||
| Senza cirrosi (411/501) | Con cirrosi (90/501) | |
| SVR12 complessivaa | 96% (395/411) | 91% (82/90) |
| Genotipo 1b | 94% (162/172) | 90% (55/61) |
| Genotipo 1a | 92% (109/118)c | 90% (46/51) |
| Genotipo 1b | 98% (52/53) | 90% (9/10) |
| Genotipo 2 | 96% (47/49) | 100% (14/14) |
| Genotipo 3 | 99% (90/91) | 100% (1/1) |
| Genotipo 4 | 96% (51/53) | 80% (8/10) |
| Genotipo 5 | 94% (16/17) | 100% (1/1) |
| Genotipo 6 | 100% (27/27) | 100% (3/3) |
| Risultati nei pazienti senza SVR | ||
| Fallimento virologico durante il trattamento | 0/411 | 0/90 |
| Recidivad | 3% (14/409) | 8% (7/89) |
| Altroe | <1% (2/411) | 1% (1/90) |
a Due pazienti senza cirrosi con genotipo indeterminato nel gruppo SOF/VEL/VOX hanno raggiunto la SVR12.
b Un paziente senza cirrosi presentava sottotipi del genotipo 1 diversi da 1a o 1b; il paziente ha raggiunto la SVR12.
c La SVR12 è dell’89% nei pazienti con genotipo 1a arruolati in centri statunitensi e del 97% nei pazienti con genotipo 1a arruolati in centri al di fuori degli Stati Uniti.
d Il denominatore per la recidiva è rappresentato dal numero di pazienti con HCV RNA
Adulti naïve ai DAA con infezione da HCV di genotipo 3 e cirrosi compensate (POLARIS-3)4
La tabella 7 presenta la SVR12 e i risultati virologici per lo studio POLARIS-3.
Tabella 7: SVR12 e risultati virologici nello studio POLARIS-3 (HCV di genotipo 3 con cirrosi compensata)*
| SOF/VEL/VOX 8 settimane (n = 110) | SOF/VEL 12 settimane (n = 109) | |
| SVR12 | 96% (106/110) | 96% (105/109) |
| Risultati nei pazienti senza SVR | ||
| Fallimento virologico durante il trattamento | 0/110 | 1% (1/109) |
| Recidivaa | 2% (2/108) | 1% (1/107) |
Altrob | 2% (2/110) | 2% (2/109) |
* Il 29% dei pazienti arruolati in POLARIS-3 era stato trattato in precedenza con un regime a base di interferone.
a. Il denominatore per la recidiva è rappresentato dal numero di pazienti con HCV RNA

Anziani
Gli studi clinici su Sofosbuvir/velpatasvir/voxilaprevir includevano 189 pazienti di età pari o superiore a 65 anni (il 17% del totale dei pazienti negli studi clinici di fase 2 e 3). I tassi di risposta osservati nei pazienti di età ≥ 65 anni sono stati simili a quelli dei pazienti di età < 65 anni in tutti i gruppi di trattamento.
Popolazione pediatrica
L’Agenzia europea dei medicinali ha rinviato l’obbligo di presentare i risultati degli studi con sofosbuvir/velpatasvir/voxilaprevir in uno o più sottogruppi della popolazione pediatrica per il trattamento dell’epatite C cronica.
Bibliografia
1) Sofosbuvir/Velpatasvir/Voxilaprevir for 12 Weeks as a Salvage Regimen in NS5A Inhibitor-Experienced Patients With Genotype 1-6 Infection: The Phase 3 POLARIS-1 Study – AASLD 2016 Nov 11-15 Boston, MA
2) A Randomized Phase 3 Trial of Sofosbuvir/Velpatasvir/Voxilaprevir for 8 Weeks Compared to Sofosbuvir/Velpatasvir for 12 Weeks in DAA-Naïve Genotype 1-6 HCV Infected Patients: The POLARIS-2 Study - AASLD 2016 Nov 11-15 Boston, MA
3) A Randomized, Phase 3 Trial of Sofosbuvir/Velpatasvir/Voxilaprevir for 8 Weeks and Sofosbuvir/Velpatasvir for 12 Weeks for Patients with Genotype 3 HCV Infection and Cirrhosis: The POLARIS-3 Study - AASLD 2016 Nov 11-15 Boston, MA
A Randomized, Controlled, Phase 3 Trial of Sofosbuvir/Velpatasvir/Voxilaprevir or Sofosbuvir/Velpatasvir for 12 Weeks in Direct-Acting Antiviral-Experienced Patients With Genotype 1-6 HCV Infection: The POLARIS-4 Study - AASLD 2016 Nov 11-15 Boston, MA



























